Методы океанографических исследований
При проведении экспедиционных работ и последующей обработке полученных проб используются стандартные современные методики.
Отбор проб и анализ донных отложений
Пробы донных отложений отбирают дночерпателем ван Виина и прямоточной ударной грунтовой трубкой (Рисунок 1). Следует отметить, что в распоряжении ЮНЦ РАН имеется детальная батиметрическая карта(Матишов, 2006а, б), и изучение донных отложений проводится не «по квадратам», а в строгой увязке с формами донного рельефа.

Для подготовки новой карты донных отложений Азовского моря (Матишов, 2007) использована классификация грунтов по механическому составу, включающая восемь гранулометрических типов осадков. В ходе типизации сделано одно отступление от принятой схемы, относящееся к автохтонным отложениям, насыщенным ракушечным компонентом: фракция ракуши крупнее 0,1 мм при расчетах механического состава вычиталась из навески и не входила в 100 %-ный объем. Аналитическая база по грунтам постоянно пополняется, что дает возможность корректировать компьютерную версию новой карты донных отложений. Масштаб карты – 1 : 280 000 (по 44°с.ш.). Наряду с типами грунта на карте отражены ареалы гравийно-галечного материала, поля ракуши и ракушечного детрита, грязевые вулканы, зоны сероводородного заражения осадков.
Данные о скорости и условиях образования различных типов донных отложений получают, используя методы абсолютной геохронологии (например, радиоуглеродное и оптически стимулированное люминесцентное датирование) в совокупности с другими методами морской геологии (например, сейсмоакустическое профилирование) и биологии (диатомовый анализ, палинологический анализ).
Суть диатомового и палинологического анализов состоит в идентификации видовой принадлежности диатомовых водорослей1 , спор и пыльцы при помощи разного рода микроскопов. На основе диатомового и палинологического анализов могут быть уточнены некоторые вопросы стратиграфии донных отложений, выявлены физикогеографические условия, существовавшие во время образования осадков. Диатомовые водоросли, пыльца и споры являются важнейшими биоиндикаторами климата голоцена и плейстоцена (Матишов, 1986). Микроскопические остатки растений и животных дают много полезной информации для палеореконструкций. У диатомовых водорослей есть кремниевый панцирь, у пыльцы – плотная пектиновая оболочка, которые хорошо сохраняются в ископаемом состоянии.
Определение концентрации хлорофилла а
Пробы воды для последующего определения концентрации хлорофилла отбирают с помощью батометров, фильтруют на месте через мембранные или стекломикроволокнистые фильтры (при отсутствии такой возможности хранят при температуре +2… +6 °С не более 2–3 часов).
Концентрацию хлорофилла а определяют в лаборатории разными способами. Общепринятым считается стандартный аналитический метод с экстрагированием пигментов раствором ацетона (в соответствии с ГОСТ 17.1.04.02-90). Существует также экспресс-метод, который основан на измерении флуоресценции проб воды
В основе стандартного аналитического метода определения хлорофилла а – спектрофотометрирование экстракта пигментов до и после подкисления раствором соляной кислоты. Расчеты концентрации хлорофилла а основаны на известных удельных спектральных показателях поглощения света хлорофиллом а и основными компонентами, мешающими анализу.
За последние годы методы определения хлорофилла в морской воде претерпели многочисленные видоизменения и улучшились. В конце 1990-х гг. стали проводиться измерения концентрации хлорофилла а в океанах и морях из космоса
Технические возможности спутников, таких как SeaStar и MODIS Aqua, позволяют сканировать каждый квадратный километр океана через каждые 48 часов, что дает возможность проводить мониторинг поверхности океана при условии отсутствия плотной атмосферной облачности и льда.
В силу своей доступности, оперативности, достаточно подробного пространственно-временного разрешения спутниковая информация существенно дополняет традиционные контактные измерения океанографических параметров и вносит существенный вклад в исследования современных климатических тенденций, разномасштабной изменчивости термодинамических и биотических полей, организацию и проведение оперативного мониторинга морских акваторий.
Отбор и анализ биологичеcких проб
Фитопланктон. Пробы фитопланктона (объемом 1,5 л) отбирают батометром Молчанова, затем фиксируют кислым раствором Люголя, в лабораторных условиях концентрируют осадочным методом до конечного объема 50–100 мл.
Для количественного учета фитопланктона сконцентрированные пробы просматривают в камере Ножотта (0,1 мл) при увеличении ×400. Крупные формы микроводорослей (более 50 мкм) учитывают во всей камере Ножотта, в двух-трех повторных наполнениях, прочие виды считают в нескольких полосах камеры (до 400 клеток). Для расчета численности микроводорослей используют стандартные формулы, расчет биомассы проводят по фактическим размерам клеток, высчитывая объем клетки по методу геометрического подобия.
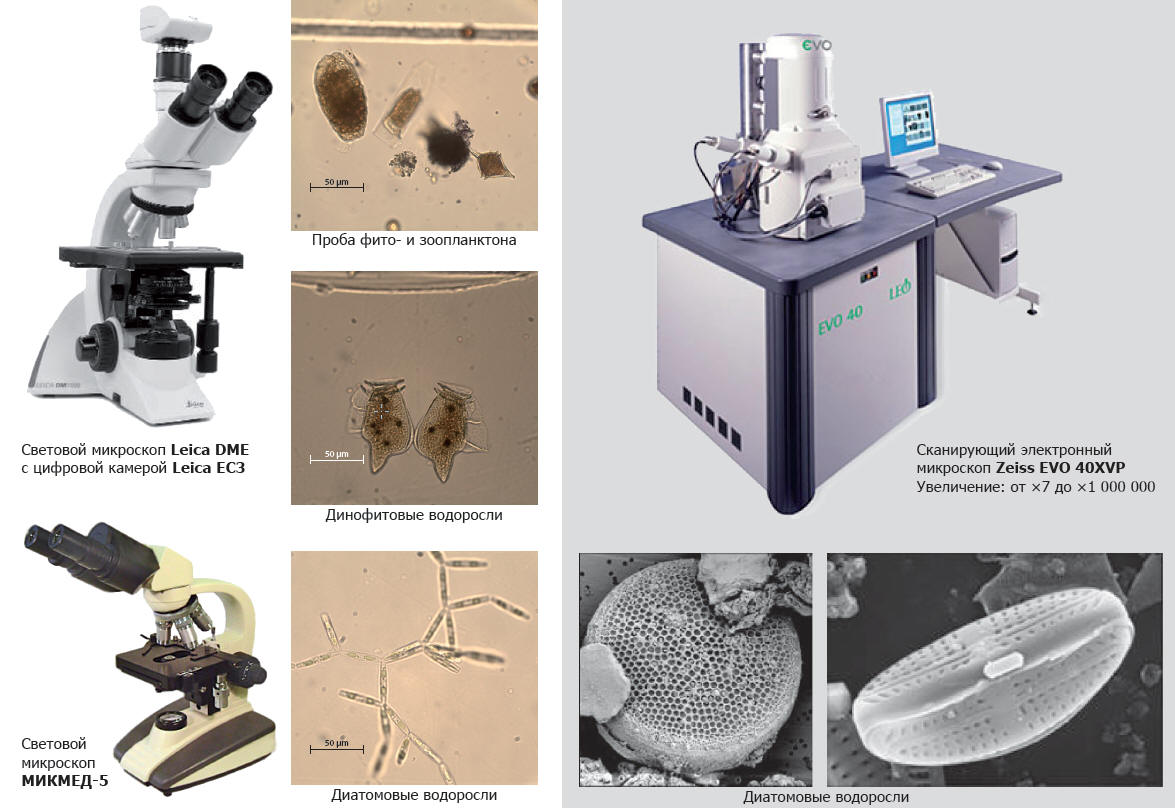
Исследования таксономического состава планктонных водорослей в Южном научном центре РАН проводят при помощи светового микроскопа Leica DME и МИКМЕД-5. Для диатомовых водорослей и пыльцы используют также электронный сканирующий микроскоп Zeiss EVO 40XVP (Рисунок 2).
Зоопланктон. Для отбора проб на мелководье (глубинах менее 5 м) используется малая сеть Апштейна, через которую процеживают около 100 л воды. На глубинах более 5 метров используется средняя планктонная сеть Джеди, которой охватывается столб воды от дна до поверхности (Рисунок 3).

Для отбора проб желетелого планктона (гребневики Mnemiopsis leidyi и Beroe ovata) используется океаническая планктонная сеть. Ее используют так же, как сеть Джеди. Общий объем пойманных особей гребневика замеряют и отдельные, случайно выбранные экземпляры измеряют в чашке Петри
Мезопланктонные пробы после фиксации и отстаивания обрабатывают в камере Богорова при помощи бинокулярного микроскопа МБС-10.
Бентос. Пробы бентоса отбирают с борта судна дночерпателями Петерсена и ван Виина трижды на каждой станции, отмечают наполнение дночерпателя и описывают особенности грунта. На мелководье отбор проб осуществляется бентосной рамкой площадью захвата 0,04 м2.
В дальнейшем животные отмываются от грунта методом флотации и процеживания через систему сит, нижнее из которых (газ-сито) имеет размер ячеи в 1 мм, что позволяет сохранить достаточно мелких гидробионтов (2–3 мм) для учета их в последующем анализе. Крупных моллюсков, полихет и ракообразных отделяют от грунта пинцетом. Фиксация проб проводится 4%-ным раствором формалина. После первичной разборки качественные пробы фиксируют 70%-ным раствором этанола. Крупные формы бентоса отбирают с применением специализированного гидробиологического трала Сигсби (Рисунок 4).

В лаборатории собранные бентосые пробы отмывают от формалина. Зообентос разбирают по систематическим группам, определяют по возможности до вида и подсчитывают численность и биомассу. Количественные и весовые данные по каждой пробе пересчитывают на 1 м2 дна. Для постоянного хранения животных перекладывают в 70%-ный раствор этанола.
Ихтиологические исследования.
Обловы водоема обычно выполняются с помощью 2-метрового или 3-метрового бимтрала и ставных сетей ячеей 18; 25; 30; 35; 40; 45 и 60 мм (Рисунок 5). Сборы ихтиологического материала по молоди рыб и оценке эффективности естественного воспроизводства ихтиофауны осуществляются с помощью 15-метровой мальковой волокуши.

Траления бимтралом с помощью моторной лодки длятся порядка 10 минут. Сети же выставляются на различном удалении от берега на несколько суток, проверка улова проводится ежедневно. Обловы мальковой волокушей осуществляются в прибрежной акватории в разных биотопах. Весь улов мальковой волокуши фиксируется 4%-ным раствором формальдегида для дальнейшей разборки и обработки в лабораторных условиях.
Весь собранный ихтиологический материал количественно учитывается, определяется видовая принадлежность рыб. По 30 экземпляров каждого вида в улове подвергается полному биологическому анализу с определением длины, массы, пола и стадии зрелости гонад, проводится взятие чешуи или отолитов для определения возраста. При небольших уловах полному биологическому анализу подвергается вся выловленная рыба. Для получения более полной и достоверной информации также анализируются уловы рыболовов-любителей и сведения работников органов рыбоохраны.



