Хлорофилл а
- Методика спектрофотометрического определения хлорофилла а
- Метод определения концентрации хлорофилла а при помощи флуориметра на основе мощных светодиодов
1. Методика спектрофотометрического определения хлорофилла а
В основе метода – спектрофотометрирование экстракта пигментов до и после его подкисления раствором соляной кислоты. Для приготовления экстракта пробу воды фильтруют через мембранный фильтр с нанесенным на нем слоем углекислого бария или магния, осадок размельчают (гомогенизируют), пигменты экстрагируют водным ацетоном из гомогената.
Порядок проведения анализа состоит из нескольких этапов:
1. Гомогенизация и экстрагирование. Слой ВаСO3, содержащий отфильтрованную взвесь, снимают скальпелем с мембранного фильтра и количественно переносят в механический гомогенизатор. После добавления туда же нескольких кубических сантиметров 90 %-ного ацетона в течение 1 мин взвесь растирают. Для экстрагирования пигментов гомогенат в течение 30 мин выдерживают при комнатной температуре. Полученный экстракт сливают в центрифужную пробирку. Осадок повторно растирают в гомогенизаторе в течение 1 мин при добавлении новой порции 90 %-ного ацетона. Через 30 мин вторую порцию экстракта вместе с осадком сливают в ту же центрифужную пробирку. Остатки экстракта и взвеси со ступицы и пестика смывают минимальным количеством 90 %-ного ацетона и также сливают в центрифужную пробирку с экстрактом. Взвесь, осажденную на фильтр из стекловолокна, допускается гомогенизировать вместе с фильтром. В этом случае следует использовать гомогенизатор со сферическими рабочими поверхностями.
2. Центрифугирование. Светорассеивающую взвесь удаляют из экстракта центрифугированием при 4000 - 5000g в течение 15 мин. Чистота экстракта контролируется по оптической плотности на 750 нм. Последняя не должна превышать 0,005Б на каждый сантиметр рабочей длины кюветы. При более высокой плотности центрифугирование следует повторить. После центрифугирования экстракт следует перенести в стеклянную мерную пробирку, при необходимости, добавляя 90 %-ный ацетон, довести его объем до объема фотометрической кюветы и закрыть пробирку притертой пробкой.
3. Спектрофотометрирование и подкисление экстракта. При спектрофотометрировании используются кюветы с рабочей длиной от 0,5 до 5 см в зависимости от объема экстракта и его оптической плотности. Отсчеты оптических плотностей берутся на четырех длинах волн - 664, 647, 630 и 750 нм. Фотометрирование проводится дважды: до и после подкисления экстракта несколькими каплями приготовленного раствора соляной кислоты в ацетоне. После добавления кислоты экстракт необходимо перемешать в течение 2 - 3 мин. При фотометрировании подкисленного экстракта отсчеты берутся на двух длинах волн 664 и 750 нм. Диапазон определяемых концентраций хлорофилла а, для которого устанавливаются пределы допускаемой погрешности определений, выполняемых по данной методике, составляет от 0,05 мг/м3 до любых максимальных значений, встречающихся в природных водах. Расчеты концентрации хлорофилла а основаны на известных удельных спектральных показателях поглощения света хлорофиллом а и основными компонентами, мешающими анализу (ГОСТ 17.1.4.02-90).
2. Метод определения концентрации хлорофилла а при помощи флуориметра на основе мощных светодиодов
Оптическая схема разработанного макета флуориметра для определения флуоресценции хлорофилла а показана на рисунке 1а.
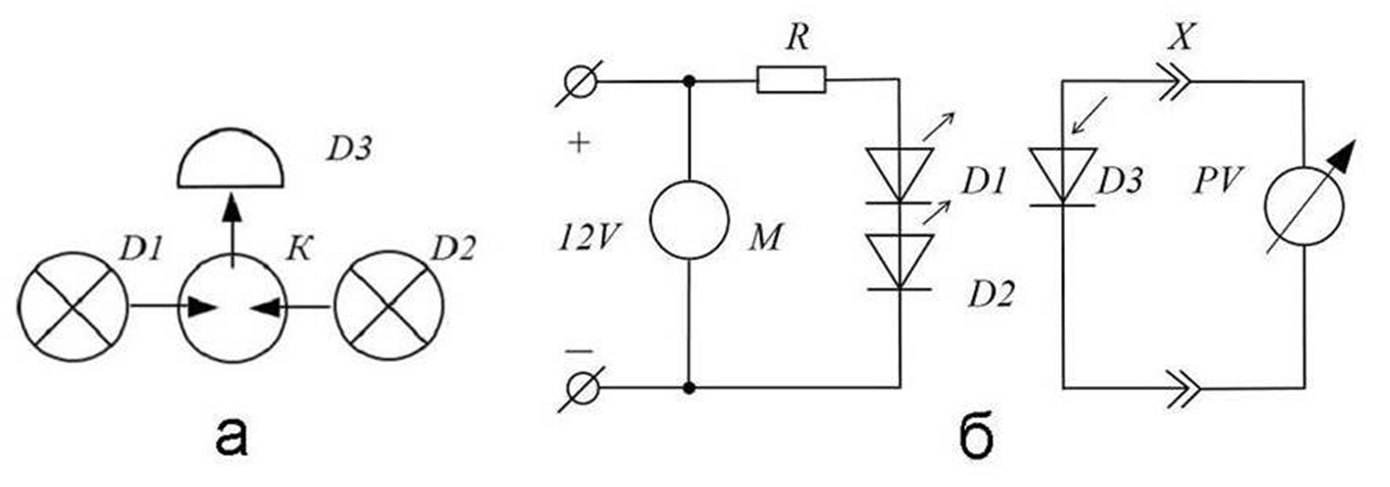
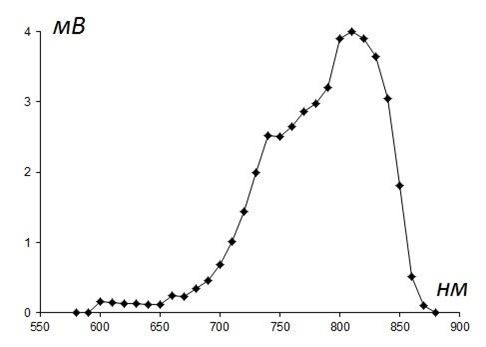
В качестве двух монохроматических источников возбуждения флуориметра D1 и D2 были использованы синие светодиоды заявленной мощностью 3 W (λmax = 465 нм, Δλ1/2 = 15 нм, Iпр = 700 mA, Uпр = 5 V, Edison Opto corp., Тайвань). Для стабилизации температурного режима и характеристик излучения светодиодов к их штатным радиаторам типа «звезда» с использованием теплопроводящей пасты крепились отрезки алюминиевого радиатора для компьютерных процессоров массой ~ 5 г. Диоды соединялись последовательно и подключались через батарею из шести резисторов МЛТ-2 R (16 Ω, 12 W) к источнику питания постоянного тока (Uвых = 12 V, Iвых = 1.5 A, ONK, КНР). В качестве приёмника излучения D3 использовался ИК-светодиод заявленной мощностью 1 W (λmax = 850 нм, Iпр = 350 mA, Uпр = 5 V, Edison Opto corp., Тайвань). Спектральная харатеристика ИК-светодиода в режиме фотодиода, показанная на рисунке 2, была измерена на фотометре UNICO 1200 (США) непосредственной регистрацией напряжения (мВ) на выводах диода для различных длин волн при облучении штатным источником света фотометра и нормализована по мощности излучения лампы фотометра.
Для охлаждения радиаторов светодиодов возбуждения к источнику питания параллельно светодиодам был подключен вентилятор M (D = 25 мм, U = 12 V, I = 90 мA, КНР). Линзы светодиодов крепились согласно оптической схеме в кюветодержателе, изготовленном из пенопласта высокой плотности. В качестве кюветы K была использована пробирка прозрачного стекла для автоанализатора (L = 32 мм, D = 12 мм, Wheaton, США) объёмом 2 мл. Для эффективного охлаждения радиаторов светодиодов вентилятором собранная конструкция была помещена в корпус с габаритами (длина х ширина х высота) 90 х 90 х 35 мм. Для измерения сигнала флуоресценции Ф (мВ) к ИК-светодиоду через разъём X подключался малогабаритный мультиметр PV (DT 182, КНР). Принципиальная электрическая схема разработанного прибора показана на рисунке 1б.
Световой поток светодиода зависит от силы протекающего через него тока, который для полупроводниковых приборов зависит от температуры. В макете была использована простейшая схема стабилизации температурного режима устройства принудительным воздушным охлаждением. Все измерения на макете выполнялись в лабораторных условиях при комнатной температуре (20 ~ 24 °С). Предварительные измерения температурного режима устройства показали рост и стабилизацию температуры источника возбуждения и приемника излучения на седьмой минуте прогрева (Δt = + 13 и + 5 °C соответственно). Все измерения на макете выполнялись через 15 минут после включения прибора. При использовании светодиодов в качестве источника излучения общепринятым является включение в цепь питания стабилизатора тока, что в данном случае может быть реализовано включением в схему соответствующей микросхемы с навесным прецизионным резистором. Для уменьшения случайной составляющей погрешности фиксировалось не менее 11 значений измерений. Объем экстракта в кювете во всех случаях составлял 1.5 мл. Перед каждой серией измерений регистрировался сигнал холостой пробы U0 (чистый 90 % ацетон). Ф рассчитывалась как:
| Φ = ∑ i=111 (U1 - U0)/ 11 | (1) |
Для калибровки показаний прибора использовались результаты стандартных определений концентрации хлорофилла а (Схл-а, мкг/мл), полученные на двулучевом спектрофотометре Evolution 300 (Thermo, США) по методике (ГОСТ 17.1.4.02-90) с использованием формулы Джеффри и Хамфри ( Jeffrey, Humphrey, 1975) без подкисления.
Пробы хлорофилла а для калибровки показаний прибора отбирались в апреле 2011 и августе 2012 года в поверхностном слое Азовского моря. Пробы фильтровались под вакуумом с использованием стекломикроволоконных фильтров MGF (Sartorius, D = 47 мм, средний размер пор - 0.7 мкм).
С целью снижения объёма пробы воды и трудозатрат для определения хлорофилла а в полевых условиях, была модифицирована методика отбора и экстрагирования проб. Для валидации показаний флуориметра одновременно с пробами хлорофилла а, отобранными в соответствии с рекомендациями (ГОСТ 17.1.4.02-90), были использованы пробы, отобранные на стекломикроволоконные фильтры MGF диаметром 13 мм. Объём профильтрованной воды изменялся в зависимости от концентрации взвеси от 10 мл (Таганрогский залив Азовского моря) до 300 мл (Чёрное море). Фильтры с взвесью высушивались и хранились в соответствии с рекомендациями (ГОСТ 17.1.4.02-90). Экстрагирование хлорофилла а с фильтров малого диаметра проводилось в пластиковых пробирках с крышкой объёмом 2 мл в течение суток при температуре 5 °С. Фильтр с взвесью измельчался в пробирке стеклянной палочкой после добавления 0.5 мл 90 % ацетона, стеклянная палочка промывалась тремя последующими порциями (0.5 мл) ацетона, добавляемыми дозатором в пробирку, таким образом, начальный объём экстракта составлял 2 мл. Одноразовые пробирки различаются скоростью испарения ацетона через закрытую крышку при экстракции (0.2 – 2 % объёма/сут.), для учета данной составляющей погрешности пробирки были предварительно откалиброваны с использованием чистого 90 % ацетона весовым методом. Экстракция хлорофилла а в течение длительного времени при пониженной температуре с растиранием рекомендуется в иностранных (Arar, Collins, 1997) и отечественных источниках (Руководство…, 2003 ). После центрифугирования (5 мин., 10000 g , Eppendorf Minispin) 1.5 мл экстракта использовались для определения Ф (Поважный В.В., 2014).



